Une entreprise experte en aromathérapie doit mettre en place de nombreux tests physiques et chimiques capables de garantir que les huiles essentielles qu'elle distribue correspondent à ce qui en est attendu : qu’elles soient vraiment pures, naturelles, de la bonne espèce, et qu’elles correspondent chimiquement à ce qu’on attend d’elles dans les ouvrages d’aromathérapie. Comment fait-elle ? Vous découvrirez dans cet article que c’est un véritable métier, alliant l’utilisation d’analyses techniques, parfois très pointues, et la nécessité d’une forte expérience de la personne qui analysera les résultats. Chaque lot qui arrive en analyse est l'objet d'une véritable enquête policière, pour connaitre son identité, son origine, son historique. Tous les outils qui vont être maintenant détaillés sont autant d’indices pour mettre en lumière une huile essentielle et répondre avec certitude à cette question : est-elle de qualité suffisante pour être utilisée en aromathérapie ?
Cet article a été mis à jour le 09/11/2022Craquez pour la Compagnie






L'analyse organoleptique
Première analyse, celle nécessitant le moins de matériel, et pourtant la plus difficile à réaliser correctement car sujette à beaucoup de subjectivité : l’analyse organoleptique. Organoleptique est un bien grand mot pour dire analyse sensorielle : en bref, l’odeur, la couleur, le gout, le toucher.
C’est ici que l’expérience du responsable qualité est critique. En effet, outre quelques critères objectifs, c’est surtout dans sa mémoire qu’il va chercher : est-ce que cette huile essentielle de Ravintsara sent vraiment le Ravintsara ? C'est bien entendu un test insuffisant, mais absolument nécessaire ! À la Compagnie des Sens, part importante des non-qualités est pré-détectée de cette manière. Bien entendu, il ne faut pas s'arrêter là, mais lorsque "l'organo" est surprenante, tous les projecteurs se tournent vers le lot en question.
La densité relative
Qu'est ce que c'est ? Comment la mesurer ?
La densité relative (d) d’une substance est le rapport entre la masse volumique de cette substance (ρ) à une température T1 et la masse volumique de l’eau à une température T2 : d = ρT1/ρeau,T2 = (m/V)T1/ρeau,T2
Généralement T1 = T2 = 20°C, cependant la densité est aussi couramment exprimée avec T2 = 4°C car alors la masse volumique de l’eau est ≈ 1, ce qui rend les calculs plus simples qu’à 20°C où elle vaut ≈ 0,998 g/cm3.
Pour simplifier, on peut dire que la densité est le lien entre le volume et la masse d’une matière (modulo la température de référence prise pour l’eau).
Elle peut être mesurée à l’aide d’un pycnomètre (solides ou liquides), d’une balance hydrostatique (solides), d’un aréomètre (liquides) ou encore d’un densimètre digital muni d’un capteur à tube oscillant (liquides et gaz).
L’instrument le plus polyvalent est le pycnomètre, car son principe de mesure est déclinable aux liquides et aux solides :
- Pour les liquides : le volume (Vpyc) du pycnomètre étant connu avec précision, il suffit de le peser (m) au moyen d’une balance de précision avant et après remplissage pour déterminer par calcul la masse volumique du produit. En effet, dliq = ρliq/ρeau = (m/Vpyc)/ρeau.
- Pour les solides : on utilise un liquide de masse volumique connue (l’eau par exemple). On pèse le pycnomètre vide, après l’introduction du solide, puis après l’introduction du liquide : ainsi, la masse du solide et celle du liquide sont connues. Connaissant le volume du pycnomètre et le volume du liquide (via la masse du liquide mliq et la masse volumique ρliq, avec Vliq = mliq/ρliq), on peut en déduire le volume Vsol et donc la masse volumique ρsol du solide. Autrement dit, dsol = ρsol/ρeau = (msol/Vsol)/ρeau = [msol/(Vpyc – (meau/ρeau))]/ρeau
A quoi sert elle ?
La densité est propre à chaque matière et permet donc de la caractériser. Pour autant, cette valeur physico-chimique n’est pas suffisante pour attester de la nature du produit (trop de matières ont des densités proches). Elle est simplement une indication qui demande plus d’investigations si la valeur trouvée est hors spécifications.
Dans le cas d’un liquide : une densité hors spécifications peut notamment mettre sur la voie d’une falsification par dilution. En effet, la densité du liquide est la moyenne des densités de chaque constituant. Par exemple, si l’on ajoutait beaucoup d’éthanol (densité ≈ 0,80) à une HE de Genévrier (densité ≈ 1,48), on risquerait de voir la densité de l’HE diminuer au point que la fraude serait facilement détectable.
Analyse C14
Qu'est ce que c'est ? Comment effectuer la mesure ?
Les matières organiques d’origine végétale contiennent du C14 (isotope naturel du carbone C12 issu du CO2 atmosphérique utilisé lors de la photosynthèse), contrairement aux matières d’origine synthétique.
Après combustion de l’échantillon, le CO2 est converti en graphite par réduction sur du fer chaud, et ce graphite est analysé à l’aide d’un spectromètre de masse à accélération de particules afin de compter le nombre de carbones 14 présents dans l’échantillon.
A quoi sert elle ?
L’analyse C14 est onéreuse, cependant elle permet d’affirmer qu’aucun composé synthétique n’a été ajouté à l'huile essentielle (contrairement à la chromatographie chirale qui ne peut l’affirmer que pour certains composés ("chiraux") de l’huile essentielle).
Indice d’acide / Acidité libre
Qu'est ce que c'est ? Comment le mesurer ?
L’indice d’acide est selon la Pharmacopée Européenne, « le nombre qui exprime en milligrammes la quantité d’hydroxyde de potassium (KOH) nécessaire à la neutralisation des acides libres présents dans 1g de substance ». Il s’exprime donc en mgKOH/g.
Le mode opératoire est un titrage classique opéré comme suit :
- Dissoudre 10,00 g (m) de l’HE dans 50 mL d’un mélange à volumes égaux d’éthanol 96° et d’éther de pétrole.
- Si nécessaire, chauffer à environ 90°C pour dissoudre l’HE.
- Neutraliser (= pH à 7) le solvant à l’aide d’hydroxyde de potassium 0,1M, en présence de 0,5 mL de solution de phénolphtaléine (= indicateur coloré).
- Après dissolution, titrer par l’hydroxyde de potassium (ou de sodium) 0,1M (= titrant). Si la solution a été chauffée pour dissoudre l’HE, maintenir la température à 90°C pendant le titrage.
- Le titrage est terminé lorsque la couleur rose persiste pendant au moins 15s. Noter le nombre n de mL de réactif titrant ajouté.
- L’indice d’acide se calcule comme suit : IA = 5,611*n/m
A quoi sert it ?
L’indice d’acide rend compte de l’altération par hydrolyse (réaction avec l’eau, l’humidité de l’air) des huiles essentielles. Si une hydrolyse se produit au sein d’une huile essentielle, c’est sa composition qui est impactée, puisqu’il s’agit d’une réaction. Ce n’est donc pas souhaité, au même titre qu’une oxydation.
Cet indice d'acide est donc très utile comme indicateur des bonnes pratiques de production de l’huile essentielle, notamment la distillation et le stockage.
Indice de peroxyde
Qu'est ce que c'est ? Comment le mesurer ?
Durant leur vieillissement, la grande majorité des huiles essentielles ont tendance à s’oxyder. Les composés les plus sensibles de l’huile "absorbent" l’oxygène et se transforment lentement en d’autres composés tels que les peroxydes, connus comme étant à la fois très réactifs et très sensibilisants (ils transmettent facilement leur état d’oxydation et induisent une hypersensibilité par exposition répétée). Bien sûr, protéger les huiles essentielles de l’oxygène (de l’air), de la lumière et des températures élevées permet de ralentir significativement le processus d'oxydation, mais en pratique, ce dernier ne peut être complètement stoppé.
A quoi sert il ?
La détermination de l’indice de peroxyde ne constitue pas l’outil ultime pour le contrôle qualité des huiles essentielles. Comme toute méthode, elle présente ses propres limites, incluant le fait que cet indice n’évolue pas de façon linéaire avec la dégradation oxydative.
Toutefois, dans la grande majorité des cas, l’indice de peroxyde apporte tout de même une information précieuse sur l’état d’oxydation des huiles essentielles (et donc leur caractère sensibilisant), une information qui n’est pas accessible avec seulement le profil chromatographique.
Indice de réfraction
Qu'est ce que c'est ? Comment le mesurer ?
Lorsque la lumière atteint un nouveau milieu, une partie de cette dernière s’y propage, mais en subissant une déviation. Ce phénomène correspond à une réfraction.
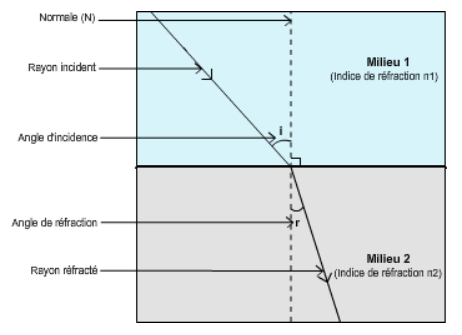
L’indice de réfraction rend compte de cette déviation entre l’air (milieu 1 pris pour référence) et le liquide à caractériser (milieu 2). Il se mesure à l’aide d’un réfractomètre et correspond à la formule suivante : sin(i)/sin(r), soit le rapport entre le sinus de l’angle d’incidence sur le sinus de l’angle de réfraction à une longueur d’onde et température données (589,3 nm « rouge-orangé » des lampes à sodium et 20°C prescrits par la Pharmacopée Européenne).
La déviation subit par le rayon lumineux, en changeant de milieu, dépend de la différence d’indice de réfraction entre les deux milieux : plus cette différence est grande et plus la déviation est importante.
Par ailleurs, si n2>
A quoi sert il ?
L’indice de réfraction est utilisé pour l’identification et comme critère de pureté des huiles essentielles et autres liquides. Chaque substance possède un indice de réfraction spécifique.
Plus l’indice de réfraction d’un produit est proche de la valeur attendue, plus sa pureté est grande. À noter cependant que cet indice est dépendant de la température du liquide (elle doit être maintenue à 20 +/- 0,5°C pour une mesure fiable).
Miscibilité à l’éthanol
Qu'est ce que c'est ? Comment le mesurer ?
La miscibilité représente la capacité de deux liquides à former un mélange homogène, c’est-à-dire constitué d’une seule phase. La solubilité est l’analogue pour les mélanges liquide-solide ou liquide-gaz. Les huiles essentielles sont plus ou moins miscibles dans l’éthanol en fonction de leur composition. Mesurer la miscibilité d’une huile essentielle permet donc de la caractériser.
Le test de miscibilité décrit dans la norme NF ISO 875 consiste à ajouter graduellement (de 0,1 mL en 0,1 mL jusqu’à 20 mL) une solution d’éthanol de titre alcoométrique convenable à une prise d’essai d’huile essentielle (1 mL), à la température de 20°C. On note ensuite le volume d’éthanol qui a provoqué le trouble ou l’opalescence (atteinte du point critique de miscibilité complète) de l’huile essentielle.
On dira de l’HE qu’elle est :
- « Soluble dans n volumes d’alcool d’un titre donné t » si la solution demeure limpide (comparée à l’HE non diluée) jusqu’à 20 mL d’alcool ajouté
- « Soluble dans n volumes d’alcool d’un titre donné t, devenant trouble après dilution » si la solution limpide dans n volumes devient trouble dans n1 volumes et le demeure jusqu’à 20 mL d’alcool ajouté.
- « Soluble dans n volumes d’alcool d’un titre donné t, avec trouble compris entre n1 et n2 volumes » si la solution lipide dans n volumes devient trouble dans n1 volumes et le demeure jusqu’à l’addition de n2 volumes d’alcool, la solution redevenant limpide.
- « Soluble avec opalescence » si la solution présente la même teinte bleuâtre qu’une solution opalescente de 0,5 mL de solution de nitrate d’argent, 0,05 mL d’acide nitrique et 50 mL de chlorure de sodium à12 mg/L (ayant reposée à l’ombre pendant 5 min).
A quoi sert il ?
La miscibilité à l’éthanol dépend directement de la composition de l’HE, notamment ses proportions en composés hydrophiles (= aimant l’eau, tels que les alcools, les cétones…) et lipophiles (= aimant l’huile, tels que les carbures…), elle permet donc de la caractériser.
Plus l’HE est hydrophile (c’est-à-dire composée en majorité de molécules hydrophiles) moins on aura besoin d’ajouter d’alcool (solvant hydrophile) pour obtenir une solution limpide, et inversement. Par le jeu des polarités, cette hydrophilie / lipophilie peut également s’inverser au cours du test de miscibilité à l’alcool, d’où l’apparition et la disparition d’un trouble (= perte de solubilité) pour certaines HE, celles-ci étant des mélanges complexes.
Une miscibilité à l’éthanol hors spécifications peut donc mettre sur la voie de :
- Une variation naturelle de sa composition.
- La dilution dans un solvant hydrophile (de l’alcool ou de l’eau par exemple) ou lipophile (un corps gras par exemple), qui de fait modifie la miscibilité à l’éthanol de l’huile essentielle.
Pouvoir rotatoire
Qu'est ce que c'est ? Comment le mesurer ?
Le pouvoir rotatoire (ou activité optique) est la propriété que présentent les substances chirales d’entraîner une rotation du plan de polarisation de la lumière polarisée rectilignement. C’est de telles substances que sont constitués les filtres polarisants.
Exemple dans le monde des HE : le limonène est une molécule chirale (= n’est pas superposable à son image dans un miroir plan, comme le sont nos mains), il possède donc 2 énantiomères (2 configurations dans l’espace de la même molécule).
- L’énantiomère lévogyre « l-limonène », « (-)-limonène » ou encore « (R)-limonène » (selon qu’on est biologiste, physicien ou chimiste) qu’on retrouve dans les huiles essentielles de pin, menthe ou encore eucalyptus.
- L’énantiomère dextrogyre « d-limonène », « (+)-limonène » ou « (S)-limonène » qu’on retrouve dans les agrumes.
Cette mesure est assurée par un polarimètre, appareil qui comprend typiquement :
- Une source lumineuse à 589 nm
- Un polariseur et un analyseur
- Une cellule de mesure présentant un trajet optique de 1,00 dm
- Un système de détection permettant de mesurer l’angle de rotation optique à 0,01° près au moins
- Un système thermostatique (interne ou externe) permettant la lecture à 0,1°C près et permettant de maintenir la température du liquide à 20+/-0,5°C.
A quoi sert cette mesure ?
Il s’agit d’une mesure physico-chimique qui permet de caractériser un liquide contenant des molécules chirales, notamment les huiles essentielles qui contiennent pour certaines des substances chirales, et donc ont une activité optique. Un pouvoir rotatoire hors spécifications peut mettre sur la voie de l’ajout d’un composé synthétique à l’HE. Par exemple, le limonène de synthèse sera un mélange racémique (= en proportions égales) de d- et l-limonène, l’activité optique sera donc différente de celle d’une HE de citron naturelle, constituée principalement de d-limonène.
Profil chromatographique en phase gazeuse
Qu'est ce que c'est ? Comment le mesurer ?
Le profil chromatographique d’une HE est le détail de sa composition, obtenu par chromatographie. La chromatographie repose sur un principe simple (mais un équipement complexe, sauf pour la CCM !) : pour connaître la composition d’un mélange, il faut :
- séparer les constituants les uns des autres ;
- les identifier.
A quoi sert cette mesure ?
C'est l'analyse la plus importante d'un plan de contrôle d'huiles essentielle. Elle permet de déterminer la composition de l’huile essentielle, et dans le cas de la chromatographie avec une colonne chirale, à détecter des cas de fraudes par ajout de composés synthétiques (uniquement dans le cas où le composé synthétique ajouté est chiral, contrairement à l’analyse C14 qui donne une réponse pour l’ensemble des consituants).
Résidu d’évaporation
Qu'est ce que c'est ? Comment le mesurer ?
- Appareillage : bain-marie avec un couvercle ayant des trous de 70 mm de diamètre, une capsule d’évaporation de verre thermorésistant inerte vis-à-vis du contenu et un dessiccateur.
- Mode opératoire :
- Peser la capsule d’évaporation après l’avoir chauffée au bain-marie pendant 1h et la laisser refroidir dans un dessiccateur.
- Peser 5,00 g d’HE dans la capsule.
- Évaporer au bain-marie, à l'abri des courant d’air pendant le temps prescrit. Durant l’essai, le niveau d’eau du bain-marie doit rester constant à 50 mm environ au-dessous du niveau du couvercle.
- Laisser refroidir dans un dessiccateur puis peser.
A quoi sert cette mesure ?
Le résidu d’évaporation permet de quantifier la fraction non-volatile de l’huile essentielle. Il est surtout utilisé pour caractériser les huiles essentielles d’agrumes obtenues par expression et riches en composés non volatils (tels les furocoumarines, qu’on ne détecte pas en chromatographie gazeuse).
« Test du buvard »
Qu'est ce que c'est ? Comment le réaliser ?
L'essai communément appelé « test du buvard » est décrit dans la Pharmacopée Européenne (chapitre "2.8.7 Huiles grasses et huiles essentielles résinifiées") pour les HE distillées uniquement : "Faites tomber 1 goutte d'HE sur du papier filtre ; la goutte doit s'évaporer entièrement dans les 24h sans laisser de tache translucide ou grasse."
A quoi sert ce test ?
Il est utilisé pour mettre en évidence la dilution de l'HE dans un corps gras. Attention, c'est un test simple à mettre en œuvre mais non fiable à 100% : si une tâche est observée, il est préférable d'effectuer des contre-analyses, comme une miscibilité à l’éthanol ou encore une chromatographie liquide.
« Test de l’eau dans les HE »
Qu'est ce que c'est ? Comment le réaliser ?
Cet essai est décrit dans la Pharmacopée Européenne (chapitre "2.8.5 Eau dans les huiles essentielles") : « Mélanger 10 gouttes d’HE avec 1 ml de sulfure de carbone. La solution reste limpide au repos. ».
A quoi sert ce test ?
Le sulfure de carbone ayant une solubilité faible avec l’eau, si la solution se trouble, c’est que l’HE contient de l’eau en proportions non acceptables.
En pratique, on évite quand même de réaliser ce test, le sulfure de carbone étant très toxique. En outre, l’eau présente dans l’HE est décelable par d’autres moyens, dont la décantation (par différence de densité entre l’HE et l’eau).
Craquez pour la Compagnie






Cet article vous a-t-il été utile ?
Note moyenne: 4.7 ( 18 votes )
À propos de ces conseils
Cet article d'aromathérapie a été rédigé par Théophane de la Charie, auteur du livre "Se soigner par les huiles essentielles", accompagné d'une équipe pluridisciplinaire composée de pharmaciens, de biochimistes et d'agronomes.
La Compagnie des Sens et ses équipes n'encouragent pas l'automédication. Les informations et conseils délivrés sont issus d'une base bibliographique de référence (ouvrages, publications scientifiques, etc.). Ils sont donnés à titre informatif, ou pour proposer des pistes de réflexion : ils ne doivent en aucun cas se substituer à un diagnostic, une consultation ou un suivi médical, et ne peuvent engager la responsabilité de la Compagnie des Sens.



